Translate
Total de visualizações da página por semana
terça-feira, 5 de dezembro de 2023
Fatores do controle vascular por íons e outros fatores químicos
segunda-feira, 27 de novembro de 2023
Diferenças entre Exercícios Isotônicos, Isocinéticos e Isométricos na Hidroterapia
terça-feira, 10 de outubro de 2023
Como ocorre a produção de hemácias e células
Produção e Desenvolvimento das Hemácias
Nos estágios iniciais do desenvolvimento embrionário, as primeiras hemácias são produzidas no saco vitelino. Essas células iniciais possuem núcleo e desempenham um papel essencial na oxigenação do embrião. À medida que a gestação avança, especialmente no segundo trimestre, o fígado se torna o principal órgão responsável pela produção dessas células, com o baço e os linfonodos também contribuindo para esse processo. No último mês de gestação e após o nascimento, a medula óssea assume totalmente essa função, tornando-se a única estrutura encarregada da formação das hemácias.
Durante os primeiros cinco anos de vida, praticamente todos os ossos do corpo participam da produção de hemácias. No entanto, com o crescimento, a medula óssea dos ossos longos, exceto as partes superiores do úmero e da tíbia, sofre um processo de transformação, tornando-se predominantemente gordurosa e perdendo a capacidade de produzir células sanguíneas. Por volta dos 20 anos de idade, a eritropoiese ocorre principalmente nos ossos membranosos, como vértebras, esterno, costelas e íleo. Com o passar dos anos, a eficiência da medula óssea na produção de hemácias tende a diminuir progressivamente.
Origem e Diferenciação das Hemácias
A formação das hemácias tem início na medula óssea a partir de células-tronco hematopoiéticas pluripotentes, que são capazes de gerar todas as células sanguíneas do organismo. Com sucessivas divisões, essas células originam diferentes linhagens celulares. Algumas delas permanecem como reserva na medula óssea para garantir a reposição contínua, embora sua quantidade diminua com o envelhecimento.
À medida que amadurecem, as células-tronco passam por estágios intermediários, nos quais já apresentam características específicas da linhagem que irão compor. Essas células especializadas são chamadas de células-tronco comprometidas. Quando cultivadas em laboratório, elas demonstram capacidade de gerar colônias específicas de células sanguíneas. Aquelas responsáveis pela produção de hemácias são denominadas unidades formadoras de colônia de eritrócitos (CFU-E, colony-forming unit-erythrocyte). De maneira similar, existem células-tronco comprometidas para granulócitos e monócitos, chamadas CFU-GM (colony-forming unit-granulocyte/macrophage).
Regulação da Produção de Hemácias
A proliferação e a diferenciação das células-tronco são reguladas por proteínas específicas, conhecidas como indutores de crescimento. Dentre esses fatores, existem quatro principais, cada um com funções distintas. Um deles é a interleucina-3, responsável por estimular a multiplicação de diversas células-tronco comprometidas. Outros indutores atuam de maneira mais específica, promovendo a diferenciação de determinados tipos de células sanguíneas.
quarta-feira, 20 de setembro de 2023
substancias hormonais que inibe as dores
Há muito tempo, descobriu-se que a injeção de pequenas quantidades de morfina em regiões específicas do cérebro, como o núcleo periventricular próximo ao terceiro ventrículo e a substância cinzenta periaquedutal do tronco cerebral, pode gerar analgesia extrema. Estudos posteriores identificaram que substâncias semelhantes à morfina, especialmente os opioides, também atuam em outras áreas do sistema de analgesia, incluindo os cornos dorsais da medula espinhal. Muitos medicamentos que afetam a excitabilidade neuronal agem diretamente sobre os receptores sinápticos. Isso levou à hipótese de que os “receptores para morfina” no sistema de analgesia poderiam, na verdade, ser receptores para neurotransmissores semelhantes à morfina, naturalmente produzidos pelo sistema nervoso. Por isso, pesquisas extensas foram realizadas para identificar o opioide natural do corpo humano.
Cerca de uma dúzia dessas substâncias opioides foram encontradas em diferentes partes do sistema nervoso. Elas são originadas da degradação de três grandes proteínas: pró-opiomelanocortina, proencefalina e prodinorfina. Entre os principais opioides naturais estão a β-endorfina, a metencefalina, a leuencefalina e a dinorfina. As encefalinas estão presentes no tronco cerebral e na medula espinhal, nas regiões descritas como parte do sistema de analgesia, enquanto a β-endorfina é encontrada no hipotálamo e na hipófise. Já a dinorfina ocorre principalmente nas mesmas áreas que as encefalinas, mas em quantidades bem menores.
Embora os detalhes do sistema opioide do cérebro ainda não sejam totalmente compreendidos, sabe-se que a ativação do sistema de analgesia por estímulos neurais que chegam à substância cinzenta periaquedutal e à região periventricular, ou pela administração de opioides como a morfina, pode praticamente suprimir os sinais dolorosos provenientes dos nervos periféricos. Além disso, outra descoberta importante no controle da dor foi que a estimulação de fibras sensoriais grandes do tipo Aβ, localizadas em receptores táteis periféricos, reduz a transmissão dos sinais de dor provenientes da mesma área corporal. Isso ocorre devido à inibição lateral local na medula espinhal, explicando por que técnicas simples, como massagens em áreas próximas à dor, são frequentemente eficazes no alívio. Esse mesmo princípio provavelmente justifica o uso de linimentos para aliviar dores localizadas.
Esse mecanismo, aliado à ativação psicogênica do sistema de analgesia central, também pode ser a base do alívio da dor proporcionado pela acupuntura. Diversas abordagens clínicas têm sido desenvolvidas com base nesse conceito. Por exemplo, estimuladores podem ser posicionados em áreas específicas da pele ou implantados na medula espinhal para atuar nas colunas sensoriais dorsais. Em alguns casos, eletrodos são colocados diretamente nos núcleos intralaminares do tálamo ou em áreas periventricular e periaquedutal do diencéfalo. Isso permite que o próprio paciente ajuste a intensidade da estimulação. Relatos mostram que, em certos casos, o alívio da dor pode durar até 24 horas após apenas alguns minutos de estímulo.
terça-feira, 19 de setembro de 2023
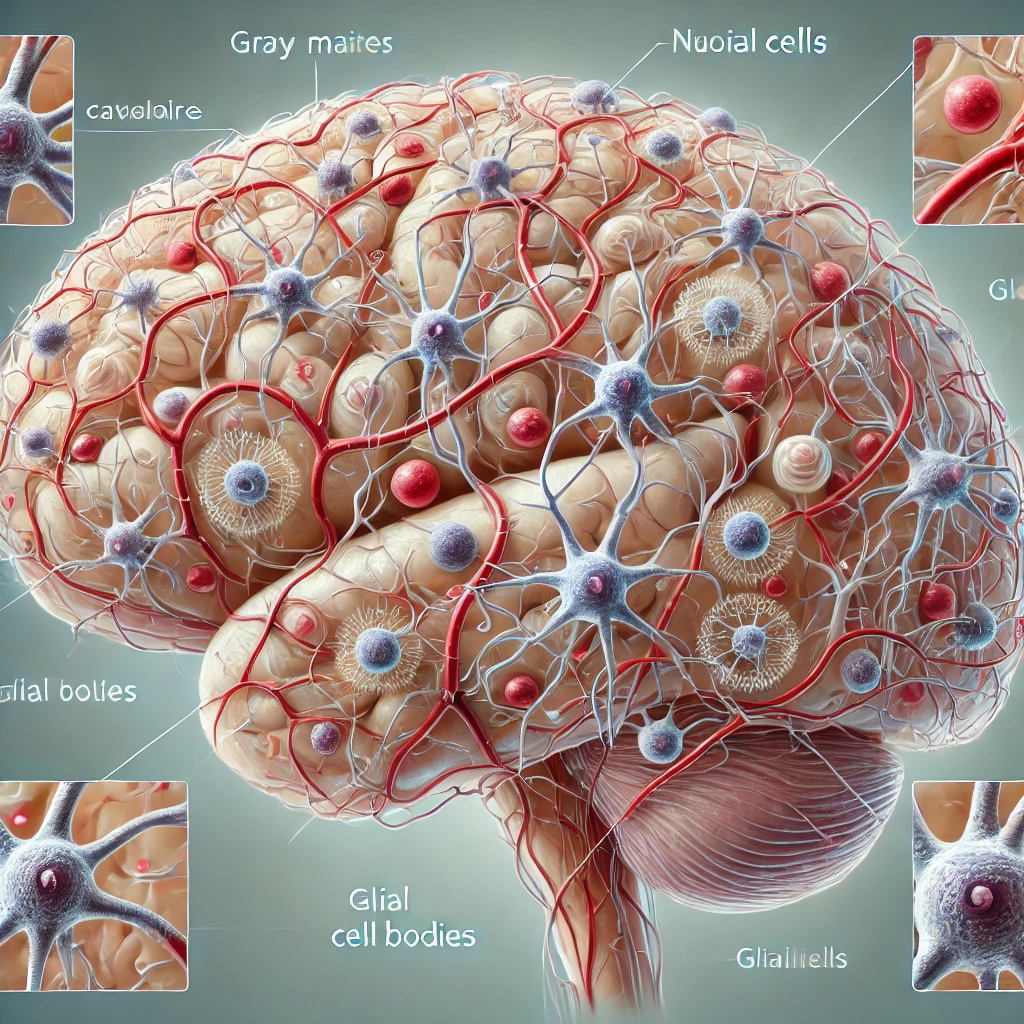
A Vascularização Cerebral e sua Relação com o Metabolismo e Doenças Vasculares
terça-feira, 12 de setembro de 2023
Músculos Esqueléticos: Como Funcionam e Por Que São Essenciais para o Movimento
O músculo esquelético é composto por diversas enzimas e uma grande quantidade de fibras musculares, que variam entre 10 e 80 micrômetros de diâmetro. Cada fibra muscular é constituída por subunidades menores e, na maioria dos casos, se estende ao longo de todo o músculo. Apenas cerca de 2% dessas fibras apresentam múltiplas terminações nervosas, sendo que a maioria é inervada por uma única terminação nervosa localizada no centro da fibra.
A membrana que reveste a fibra muscular esquelética é chamada de sarcolema, sendo formada por uma membrana celular (membrana plasmática) e uma fina camada externa composta por material polissacarídico com fibrilas colágenas delgadas. Essa estrutura tem papel fundamental na conexão entre o músculo e os tendões. Nas extremidades da fibra muscular, o sarcolema se une às fibras do tendão, que por sua vez formam feixes responsáveis pela fixação do músculo aos ossos.
segunda-feira, 11 de setembro de 2023
Como os Músculos se Movem? O Segredo Está na Miosina e Actina!
De acordo com o Tratado de Fisiologia Médica, os filamentos de miosina são essenciais para a contração muscular e são compostos por múltiplas moléculas de miosina. Cada uma dessas moléculas possui um peso molecular aproximado de 480.000 e se organiza estruturalmente para formar os filamentos espessos do sarcômero. A miosina é uma proteína motora que interage com a actina para gerar força e movimento muscular.
Postagem em destaque
Recuperação Pós-Cirurgia de Clavícula: A Importância dos Cuidados e da Fisioterapia na Reabilitação
A cirurgia de clavícula, geralmente realizada após fraturas ou lesões graves, é um procedimento que exige atenção especial no período pós-o...

-
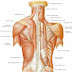
O TRAPÉZIO A parte superior das costas é formada por um grande músculo de forma triangular chamado trapézio. Ele se origina ao lon...
-
Metaplasia é uma alteração reversível na qual um tipo celular diferenciado (epitelial ou mesenquimal) é substituído por outro tipo celular. ...
-
Os testes ortopédicos para avaliar os músculos subescapular, supraespinhal (supraescapular) e infraespinhal (infraescapular) são fundamentai...