anuncio
anuncio
O genoma humano
O genoma humano foi totalmente sequenciado e, como resultado, muito se aprendeu a respeito da “arquitetura genética” dos seres humanos. 1 Algumas das características descobertas sobre o genoma humano, aliás, mostraram-se inesperadas. Por exemplo, menos de 2% do genoma humano codifica proteínas, enquanto metade do genoma é formada por blocos de sequências de DNA repetitivo cujas funções permanecem misteriosas. Porém, a descoberta totalmente inesperada foi o fato dos seres humanos possuírem de 20.000 a 25.000 genes que codificam proteínas em seu genoma, contrariando previsões anteriores que estimaram a presença de mais de 100.000 genes. Essa quantidade de genes presentes no genoma humano é semelhante à quantidade de genes presentes no genoma da planta mostarda, ou seja, 26.000 genes! Porém, sabe-se também que, através do processamento alternativo do RNA mensageiro, esses 25.000 genes humanos podem gerar mais de 100.000 proteínas. Os seres humanos, portanto, não são tão pobres afinal de contas. Com o término do Projeto do Genoma Humano, um novo termo foi adicionado ao vocabulário médico: genômica. Enquanto a genética estuda alguns poucos genes e seus efeitos fenotípicos, a genômica estuda todos os genes no genoma e suas interações. 2 A análise de tumores por microarranjo de DNA é um exemplo excelente de aplicação clínica atual da genômica.
Apendicite Aguda
 O apêndice é um divertículo verdadeiro normal do ceco que está sujeito a inflamação aguda ou crônica. A apendicite aguda é mais comum em adolescentes e jovens adultos, mas pode ocorrer em qualquer grupo de idade. O risco de vida para a apendicite é de 7%; os homens são levemente mais afetados do que as mulheres. A despeito da prevalência da apendicite aguda, o diagnóstico pode ser difícil de confirmar pré-operativamente e ela pode ser confundida com a linfadenite mesentérica (frequentemente secundária a uma infecção por Yersinia não reconhecida ou uma enterocolite viral), salpingite aguda, gravidez ectópica, mittelschmerz (dor causada por sangramento pélvico mínimo no momento da ovulação) e divertículo de Meckel.
O apêndice é um divertículo verdadeiro normal do ceco que está sujeito a inflamação aguda ou crônica. A apendicite aguda é mais comum em adolescentes e jovens adultos, mas pode ocorrer em qualquer grupo de idade. O risco de vida para a apendicite é de 7%; os homens são levemente mais afetados do que as mulheres. A despeito da prevalência da apendicite aguda, o diagnóstico pode ser difícil de confirmar pré-operativamente e ela pode ser confundida com a linfadenite mesentérica (frequentemente secundária a uma infecção por Yersinia não reconhecida ou uma enterocolite viral), salpingite aguda, gravidez ectópica, mittelschmerz (dor causada por sangramento pélvico mínimo no momento da ovulação) e divertículo de Meckel.
LESÃO QUÍMICA (TÓXICA)
 A lesão química permanece como um problema frequente na medicina clínica, e é a principal limitação à terapia com drogas. Como muitas drogas são metabolizadas no fígado, este órgão é alvo frequente da toxicidade das drogas. De fato, a lesão hepática tóxica é, talvez, a razão mais frequente para o término do uso terapêutico ou desenvolvimento de uma droga.
A lesão química permanece como um problema frequente na medicina clínica, e é a principal limitação à terapia com drogas. Como muitas drogas são metabolizadas no fígado, este órgão é alvo frequente da toxicidade das drogas. De fato, a lesão hepática tóxica é, talvez, a razão mais frequente para o término do uso terapêutico ou desenvolvimento de uma droga.Os mecanismos pelos quais as substâncias químicas, certas drogas e toxinas produzem lesão , na discussão sobre doenças ambientais. Aqui, descreveremos as principais vias de lesão quimicamente induzida, com exemplos selecionados. As substâncias químicas induzem lesão celular por um de dois mecanismos gerais:
Algumas substâncias químicas atuam diretamente pela combinação com componentes moleculares críticos. Por exemplo, no envenenamento por cloreto de mercúrio, o mercúrio se liga aos grupamentos sulfidrila das proteínas de membrana celular, causando aumento da permeabilidade da membrana e inibição do transporte de íons. Nesses casos, a maior lesão ocorre nas células que usam, absorvem, excretam ou concentram as substancias químicas – no caso do cloreto mercúrico, as células do trato gastrointestinal e do rim . O cianeto envenena a citocromo-oxidase mitocondrial e inibe a fosforilação oxidativa. Muitos agentes quimioterápicos antineoplásicos e antibióticos também induzem lesão celular por efeitos citotóxicos diretos.
LESÃO DE ISQUEMIA-REPERFUSÃO
 A restauração do fluxo sanguíneo para tecidos isquêmicos pode promover a restauração das células, se estas foram lesadas de modo reversível. No entanto, sob certas circunstâncias, quando o fluxo sanguíneo é restaurado para as células que estavam isquêmicas, mas não mortas, a lesão é paradoxalmente exacerbada e prossegue em ritmo acelerado. Como resultado, os tecidos reperfundidos continuam a perder células, além daquelas que foram lesadas irreversivelmente no fim da isquemia.
A restauração do fluxo sanguíneo para tecidos isquêmicos pode promover a restauração das células, se estas foram lesadas de modo reversível. No entanto, sob certas circunstâncias, quando o fluxo sanguíneo é restaurado para as células que estavam isquêmicas, mas não mortas, a lesão é paradoxalmente exacerbada e prossegue em ritmo acelerado. Como resultado, os tecidos reperfundidos continuam a perder células, além daquelas que foram lesadas irreversivelmente no fim da isquemia.Esse processo, denominado lesão de isquemia-reperfusão, é clinicamente importante porque contribui para danos no tecido em infartos do miocárdio e cerebrais e em seguida a terapias para restaurar o fluxo sanguíneo . Como ocorre a lesão de reperfusão? A resposta provável é que novos processos lesivos são desencadeados durante a reperfusão, causando a morte de células que, de outro modo, poderiam ter se recuperado.
Mecanismos da Lesão Celular Isquêmica
 A sequência de eventos que acompanha a hipoxia ou isquemia reflete muitas das alterações bioquímicas da lesão celular que foram já descritas. Quando a tensão de oxigênio dentro da célula diminui, ocorre perda da fosforilação oxidativa e diminuição da geração de ATP. A depleção de ATP resulta em falha da bomba de sódio, com perda de potássio, influxo de sódio e água e tumefação celular. Ocorre também influxo de cálcio, com muitos dos seus efeitos deletérios. Há uma perda progressiva de glicogênio e redução da síntese de proteínas. Neste estágio, as consequências funcionais podem ser graves. Por exemplo, o músculo cardíaco cessa a contração dentro de 60 segundos de oclusão coronária. Entretanto, a perda de contratilidade não significa morte celular. Se a hipoxia continuar, a piora da depleção de ATP causará degeneração adicional. O citoesqueleto se dispersa, levando à perda de características ultraestruturais como as microvilosidades e formação de “bolhas” na superfície celular . “Figuras de mielina”, derivadas das membranas celulares em degeneração, podem ser vistas dentro do citoplasma (em vacúolos autofágicos) ou no meio extracelular. Acredita-se que elas sejam resultado de grupos fosfatídeos que promovem a captação e a inserção de água entre as pilhas de lamelas de membranas. ( mais sobre bomba de sodio aqui: http://goldfisio.blogspot.com.br/2017/11/a-atividade-da-bomba-de-sodio.html )
A sequência de eventos que acompanha a hipoxia ou isquemia reflete muitas das alterações bioquímicas da lesão celular que foram já descritas. Quando a tensão de oxigênio dentro da célula diminui, ocorre perda da fosforilação oxidativa e diminuição da geração de ATP. A depleção de ATP resulta em falha da bomba de sódio, com perda de potássio, influxo de sódio e água e tumefação celular. Ocorre também influxo de cálcio, com muitos dos seus efeitos deletérios. Há uma perda progressiva de glicogênio e redução da síntese de proteínas. Neste estágio, as consequências funcionais podem ser graves. Por exemplo, o músculo cardíaco cessa a contração dentro de 60 segundos de oclusão coronária. Entretanto, a perda de contratilidade não significa morte celular. Se a hipoxia continuar, a piora da depleção de ATP causará degeneração adicional. O citoesqueleto se dispersa, levando à perda de características ultraestruturais como as microvilosidades e formação de “bolhas” na superfície celular . “Figuras de mielina”, derivadas das membranas celulares em degeneração, podem ser vistas dentro do citoplasma (em vacúolos autofágicos) ou no meio extracelular. Acredita-se que elas sejam resultado de grupos fosfatídeos que promovem a captação e a inserção de água entre as pilhas de lamelas de membranas. ( mais sobre bomba de sodio aqui: http://goldfisio.blogspot.com.br/2017/11/a-atividade-da-bomba-de-sodio.html )LESÃO ISQUÊMICA E HIPÓXICA
 Esse é o tipo mais comum de lesão celular em medicina clínica e tem sido estudado extensamente em humanos, em animais de laboratório e em sistemas de cultura. A hipoxia, que se refere à redução do oxigênio disponível, pode ocorrer em uma variedade de contextos clínicos, descritos anteriormente. Ao contrário, na isquemia o suprimento de oxigênio e nutrientes é diminuído, mais frequentemente como consequência de obstrução mecânica no sistema arterial. Ela também pode ser causada por redução da drenagem venosa. Ao contrário da hipoxia, durante a qual a produção de energia através da glicólise anaeróbica continua, a isquemia também compromete a distribuição de substratos para a glicólise. Assim, nos tecidos isquêmicos, não apenas o metabolismo aeróbico é comprometido, mas a geração de energia anaeróbica também cessa depois que os substratos glicolíticos são exauridos ou quando a glicólise é inibida pelo acúmulo de metabólitos que normalmente poderiam ser removidos pelo fluxo sanguíneo. Por esta razão, a isquemia tende a causar lesão celular e tecidual mais rápida e intensa que a hipoxia na ausência de isquemia
Esse é o tipo mais comum de lesão celular em medicina clínica e tem sido estudado extensamente em humanos, em animais de laboratório e em sistemas de cultura. A hipoxia, que se refere à redução do oxigênio disponível, pode ocorrer em uma variedade de contextos clínicos, descritos anteriormente. Ao contrário, na isquemia o suprimento de oxigênio e nutrientes é diminuído, mais frequentemente como consequência de obstrução mecânica no sistema arterial. Ela também pode ser causada por redução da drenagem venosa. Ao contrário da hipoxia, durante a qual a produção de energia através da glicólise anaeróbica continua, a isquemia também compromete a distribuição de substratos para a glicólise. Assim, nos tecidos isquêmicos, não apenas o metabolismo aeróbico é comprometido, mas a geração de energia anaeróbica também cessa depois que os substratos glicolíticos são exauridos ou quando a glicólise é inibida pelo acúmulo de metabólitos que normalmente poderiam ser removidos pelo fluxo sanguíneo. Por esta razão, a isquemia tende a causar lesão celular e tecidual mais rápida e intensa que a hipoxia na ausência de isquemia
Colágeno
 O colágeno é a proteína mais comum no mundo animal, constituindo o arcabouço extracelular para todos os organismos multicelulares. Sem o colágeno, o ser humano seria reduzido a um aglomerado de células, semelhante ao “Blob” (o “horror gelatinoso do espaço” famoso, em filme da década de 1950), interconectado por alguns neurônios. Atualmente, são conhecidos 27 tipos diferentes de colágenos, codificados por 41 genes dispersos em pelo menos 14 cromossomos 72 . Cada colágeno é composto de três cadeias que formam um trímero na forma de hélice tripla. O polipeptídeo é caracterizado por uma sequência que se repete, na qual a glicina está na terceira posição (Gly-X-Y, em que X e Y podem ser qualquer outro aminoácido que não cisteína ou triptofano) e contém os aminoácidos especializados 4hidroxiprolina e hidroxilisina. Os resíduos de prolina na posição Y são hidroxilados para produzir hidroxiprolina, que estabiliza a hélice tripla. Os tipos I, II, III, V e XI são os colágenos fibrilares, nos quais o domínio da tripla hélice é ininterrupto por mais de 1.000 resíduos; essas proteínas são encontradas nas estruturas fibrilares extracelulares. Os colágenos tipo IV possuem domínios longos da tripla hélice, porém interrompidos, e formam bainhas em vez de fibrilas, constituindo os principais componentes da membrana basal, em associação com a laminina. Um outro colágeno com domínio de tripla hélice longo e interrompido (tipo VII) forma as fibrilas de ancoragem entre algumas estruturas epiteliais e mesenquimais, como na epiderme e derme. Outros colágenos, ainda, são transmembrana e podem auxiliar também a ancoragem de estruturas epidérmicas e dérmicas.
O colágeno é a proteína mais comum no mundo animal, constituindo o arcabouço extracelular para todos os organismos multicelulares. Sem o colágeno, o ser humano seria reduzido a um aglomerado de células, semelhante ao “Blob” (o “horror gelatinoso do espaço” famoso, em filme da década de 1950), interconectado por alguns neurônios. Atualmente, são conhecidos 27 tipos diferentes de colágenos, codificados por 41 genes dispersos em pelo menos 14 cromossomos 72 . Cada colágeno é composto de três cadeias que formam um trímero na forma de hélice tripla. O polipeptídeo é caracterizado por uma sequência que se repete, na qual a glicina está na terceira posição (Gly-X-Y, em que X e Y podem ser qualquer outro aminoácido que não cisteína ou triptofano) e contém os aminoácidos especializados 4hidroxiprolina e hidroxilisina. Os resíduos de prolina na posição Y são hidroxilados para produzir hidroxiprolina, que estabiliza a hélice tripla. Os tipos I, II, III, V e XI são os colágenos fibrilares, nos quais o domínio da tripla hélice é ininterrupto por mais de 1.000 resíduos; essas proteínas são encontradas nas estruturas fibrilares extracelulares. Os colágenos tipo IV possuem domínios longos da tripla hélice, porém interrompidos, e formam bainhas em vez de fibrilas, constituindo os principais componentes da membrana basal, em associação com a laminina. Um outro colágeno com domínio de tripla hélice longo e interrompido (tipo VII) forma as fibrilas de ancoragem entre algumas estruturas epiteliais e mesenquimais, como na epiderme e derme. Outros colágenos, ainda, são transmembrana e podem auxiliar também a ancoragem de estruturas epidérmicas e dérmicas.
Assinar:
Postagens (Atom)
anuncio
Postagem em destaque
Maca dobrável portátil para home Care ou consultório
Está maca maleta está disponível no mercado livre em seis cores diferentes para agradar os diversos tipos de gostos, a maca possui pés de al...
.jpeg)
Anúncio
-
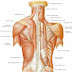
O TRAPÉZIO A parte superior das costas é formada por um grande músculo de forma triangular chamado trapézio. Ele se origina ao lon...
-
Valvas cardíacas : As " as cordas do coração ", ou cordas tendíneas , são estabilizadores constituídos por colágeno. Elas mant...
-
Metaplasia é uma alteração reversível na qual um tipo celular diferenciado (epitelial ou mesenquimal) é substituído por outro tipo celular. ...
-
Cada músculo tem sua função e ao longo do tempo vou explicar um pouco de cada musculo para vocês . Músculo é feito, basicamente, de ...
-
A depleção de ATP e a redução de síntese de ATP são frequentemente associadas com lesão isquêmica e química (tóxica). O ATP é produzido de...
anuncio
https://www.videosprofitnetwork.com/watch.xml?key=11f90dc865dcda39d919ec27ff5ed384